2017年12月22日,CFDA发布《细胞治疗产品研究与评价技术指导原则》(试行),正式为我国细胞治疗产品作为药品属性的规范化、产业化生产拉开序幕。根据该指导原则,默赛尔生物研发出了针对实体瘤的双靶点CAR-NK抗肿瘤细胞药,目前市场上尚没有CAR-NK细胞药相关研究及申报,具有较高的创新性。CAR-NK细胞药与CAR -T细胞相比,不会产生致死性的细胞因子风暴,可以使用异体细胞治疗,轻松实现 “off -the-shelf ”的药物生产需求;其次,我们构建了双信号嵌合抗原受体,确保CAR-NK细胞能够更为快速精准的识别高代谢恶性肿瘤细胞并进行杀伤;另外,我们在嵌合抗原受体慢病毒表达载体中加入了安全性开关,当不需要输入的NK细胞发挥作用的时候,就可以关闭CAR-NK,从而确保CAR-NK临床应用的安全性,如图1所示。
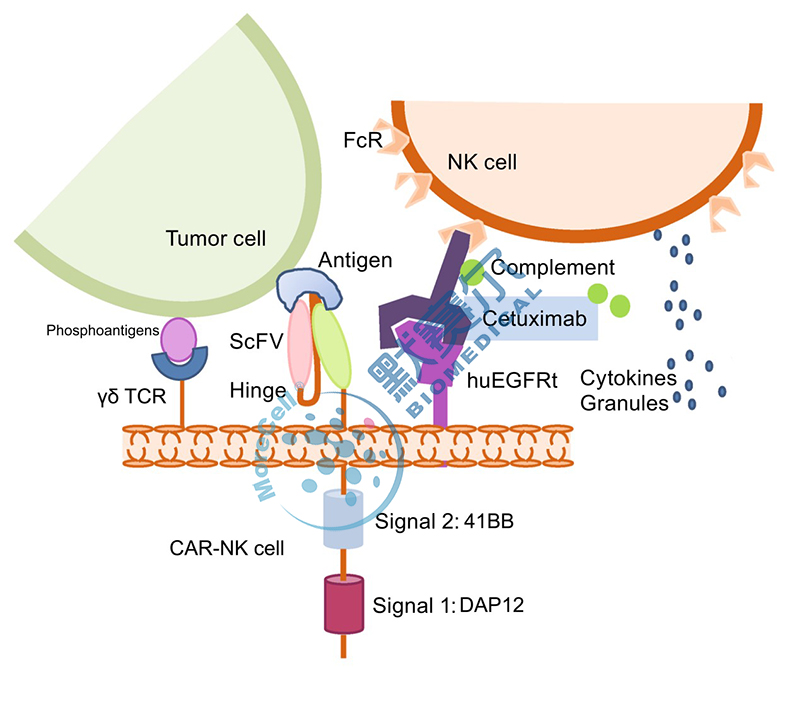
双靶点CAR-NK结构示意图
默赛尔生物的双靶点CAR-NK抗肿瘤细胞药目前已完成了技术研发和临床前研究,取得了较好的疗效和安全性指标。目前我公司正在与CRO公司合作,准备IND临床研究申报材料,将把CAR-NK细胞药以1类新药递交临床试验申请;待审批通过,拿到临床研究批件后,将与10家以上医院进行CAR-NK细胞药的I期、II期临床实验,争取两年内获得优先审批资质,通过NDA申请,最终获得CAR-NK细胞药上市批文。

![二维码[2021-12-26 16:43:25]
二维码[2021-12-26 16:43:25]](/Upload/1640508252.jpg)

