融合蛋白在分子生物学中的应用极为广泛,最简单的应用是在蛋白质的末端连上标签,用于WB检测或纯化。复杂一些的应用则是将需要研究的目的蛋白与另一个标记蛋白连接:当标记蛋白为荧光蛋白时,可将目的蛋白的示踪和图像学分析;标记蛋白为白蛋白或者抗体Fc片段时,可用于延长目的蛋白的半衰期;又或者将两个目的蛋白连接,用于研究他们的共同功能或者相互作用。
作为需要使用融合蛋白的科研工作者,了解一些必要的Linker知识,将使得您在设计质粒方面更加得心应手。本文将介绍一下天然形式下的蛋白Linker和目前应用最广泛的人工合成Linker,以及他们的特性;其次介绍通过增加蛋白Linker实现的各种功能,包括提高折叠和稳定性,促进蛋白质表达,增加内在生物学活性;最后介绍如何使用在线工具设计Linker。
我们通常将使用的蛋白Linker分为3种,分别为柔性Linker、刚性Linker以及可剪切(或自剪切)Linker。
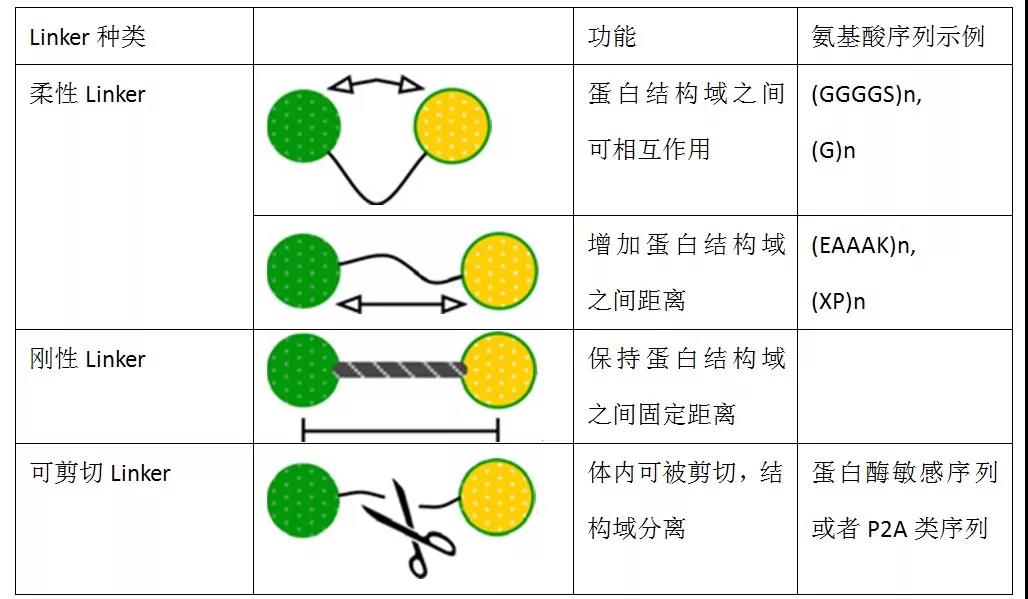
柔性Linker
最常见的柔性Linker就是G(Gly)甘氨酸和S(Ser)丝氨酸的GS组合,最常用的GS组合就是(Gly-Gly-Gly-Gly-Ser)n,通过改变n的大小,研究者可以将结构域之间的距离放大和减小,实现结构域分离(n≥2)或连接结构域,研究其相互作用。
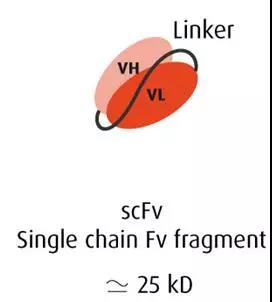
其他一些常见的蛋白Linker具有一些特定的用途,例如单链可变片段(single chain variable fragment (scFv))中,连接重链可变区(VH)和轻链可变区(VL)的柔性Linker,通常为KESGSVSSEQLAQFRSLD和 EGKSSGSGSESKST。这些序列中甘氨酸(Gly)和丝氨酸(Ser)提供柔软度,谷氨酸(Glu)和赖氨酸(Lys)提高水溶性。
更简单粗暴一些的柔性Linker就是纯甘氨酸(Gly)组成的(Gly)8,或短一点点的(Gly)6,它们的优点是在酵母表达纯化过程中,能够抵抗蛋白酶的水解,同时保护两端蛋白结构域的功能活性。
刚性Linker
具有(EAAAK)n序列的α-螺旋形成的Linker具有内部氢键和密切联系肽链骨干,刚性且稳定。因此,刚性α-螺旋Linker可作为蛋白质结构域之间的刚性间隔。通过将蓝色荧光蛋白(EBFP)和绿色荧光蛋白(EGFP)连接在一起,评估荧光共振能量转移(FRET)之间的效率,可以发现(EAAAK)n序列连接两个荧光蛋白时,荧光共振能量转移效率比(GGGGS)n序列低,说明α-螺旋Linker能够有效的隔离两个不同的蛋白结构域。
另一种类型的刚性Linker具有Pro-rich序列(XP)n,其中X可指定任何氨基酸,推荐选择丙氨酸(Ala),赖氨酸(Lys)或谷氨酸(Glu)。(XP)n序列没有螺旋结构,Linker中存在的脯氨酸(Pro)可以增加骨架硬度,并且有效分离结构域。富含脯氨酸序列的结构在机体中广泛的存在,例如骨骼肌蛋白的N端就存在(Ala-Pro)7的结构。
刚性Linker表现出相对坚硬的结构,能够有效的将两端的蛋白结构域分开,通过改变n的大小,就能够轻易调整结构域之间的最佳距离,从而保证两端蛋白的活性与生物功能。
可剪切Linker
到目前为止讨论的Linker通常不会在体内裂解。这些稳定的接头共价连接两个功能域,使得融合蛋白在体内变成一个蛋白。功能结构域之间的稳定连接提供许多优点,例如延长的血浆半衰期(例如白蛋白或Fc融合)。然而,它也有一些潜在的缺点,包括功能域之间的空间位阻,生物活性降低,以及由于域之间的干扰导致蛋白质部分的生物分布和代谢方式改变。在这些情况下,引入可剪切Linker,使得融合蛋白能够在体内释放,分离两个功能结构域。
一个研究的比较透彻的过程是二硫键的还原。这个可剪切Linker序列为LEAGCKNFFPR↓SFTSCGSLE,基于二硫环肽,在接头上的两个半胱氨酸(Cys)残基之间形成的分子内二硫键,同时这个序列对凝血酶敏感。在凝血酶的作用下能够有效的对Linker中凝血酶敏感序列(PRS)进行切割。
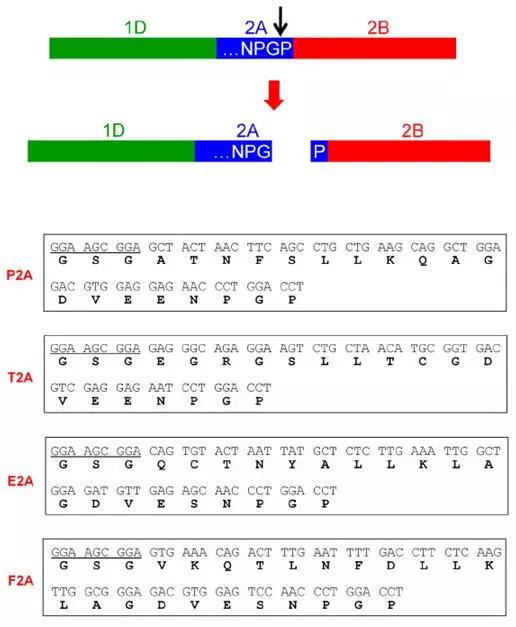
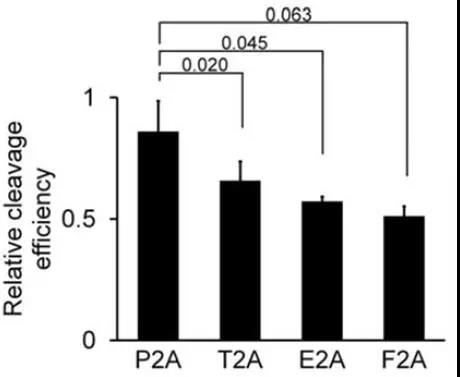
其他比较流行的可剪切Linker,能够不依赖蛋白酶,自行进行切割处理,使得两个结构域断裂。这些自剪切Linker通为2A短肽,通常在序列NPG↓P进行自剪切分离。2A短肽通常来源于病毒的蛋白质序列,例如P2A表示来源于猪捷申病毒(porcine teschovirus-1);E2A表示来源于马鼻炎病毒(equine rhinitis A virus);F2A表示来源于口蹄疫病毒(Footand Mouth Disease Virus)。由于自剪切效率各有不同,2A短肽之间也存在一定差异,我们一般推荐使用P2A或T2A序列。
如何设计Linker
随着对天然多结构域蛋白中的Linker和重组融合蛋白的广泛研究,研究者们萌生了构建数据库的想法,提出了Linker设计工具,基于融合蛋白的期望特性来合理设计Linker。这种类型的工具的一个典型例子是名为synlinker的程序,该程序在用户指定的输入(例如Linker长度,要避免的蛋白酶敏感序列)中搜索其连接子序列的数据库,并生成几个连接子序列的输出。Linker数据库是基于这样的假设建立的,即在X射线晶体结构或NMR溶液结构中观察到的环序列可能采用延伸构象作为融合蛋白中的Linker。最终的数据库包含14,734个序列,它们包含PDB文件中的记录,可自动识别蛋白质的二级和环状结构。程序的基本输入是Linker序列的期望长度,通常表示为残基数量或以埃为单位的距离。额外的输入参数包括,避免被蛋白酶或限制性内切酶切割,使得选择的Linker在克隆过程中对特定蛋白酶稳定或序列对限制性内切酶具有抗性。使用者还可以加入氨基酸组成偏好(例如,消除疏水性残基)以进一步选择其感兴趣的Linker。此程序可以作为生成Linker序列的工具,使用十分便利(http://synlinker.syncti.org/)。
不过,如果您觉得设计Linker有些麻烦,构建质粒也无从下手,且耗时费力,那么把这些工作交给专业的科研服务供应商不失为一个便捷、高效的选择。默赛尔生物公司专业提供质粒构建服务,协助您量身定制科研计划。默赛尔生物公司凭借在分子生物学领域积累的丰富的工作经验,可根据已有载体进行各种改造方案的设计,我们的服务内容有:
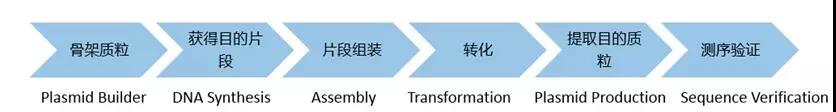
设计引物,从克隆载体(或基因组、cDNA模板)上扩增目的基因片段。
处理载体,进行目的基因与载体的连接。
转化连接目的基因的载体,并转化感受态,鉴定阳性质粒。
对连接目的基因的载体进行DNA测序。
将阳性质粒保存菌种,质粒和测序报告提交给客户。
针对客户要求对现有质粒结构进行改造。
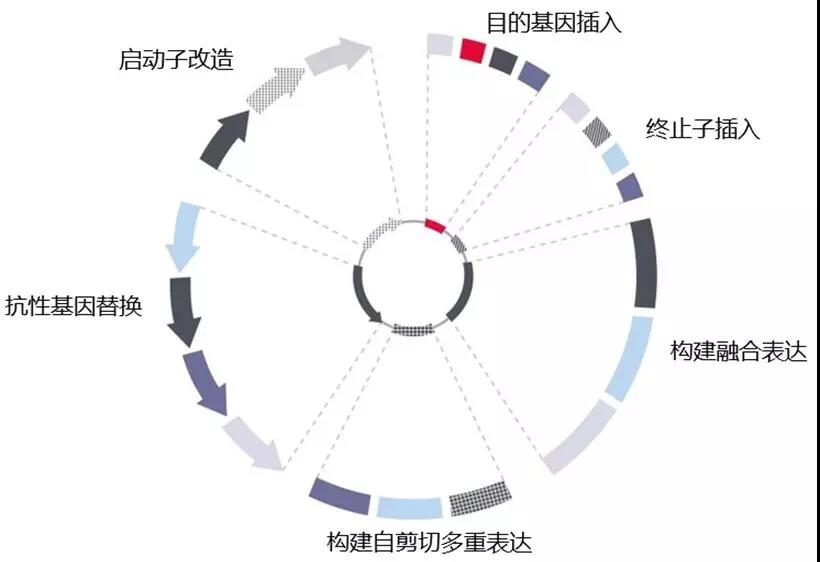
为什么选择我们的质粒构建服务?
• 低风险-质粒的组件经过预先测试,可以在质粒构建完成时,减少表达出现问题的几率。
• 周期短–高素质的员工以及完善的试验流程可为您提供最快速的实验结果,提高您的实验效率,加快您发表文章。
• 极高性价比–为您制备质粒的员工均为资深的分子生物工程师,为您提供质粒构建服务的同时,也提供完善的实验报告和质粒图谱,让您在撰写文章和提供实验方法时只需复制粘贴。
默赛尔生物将竭诚为您服务!
服务示例:


参考文献
[1] Fusion proteinlinkers: property, design and functionality. Adv Drug Deliv Rev. 2013 Oct;65(10):1357-69. doi: 10.1016/j.addr.2012.09.039. Epub 2012 Sep 29.
[2] Effect oflinker flexibility and length on the functionality of a cytotoxic engineeredantibody fragment. J. Biotechnol. 2015. 199: 90-97.
[3] High cleavageefficiency of a 2A peptide derived from porcine teschovirus-1 in human celllines, zebrafish and mice. PLoS One. 2011; 6(4):e18556. doi:10.1371/journal.pone.0018556. Epub 2011 Apr 29.
 关注公司微信公众号
关注公司微信公众号 地址:深圳市龙华新区宝能科技园