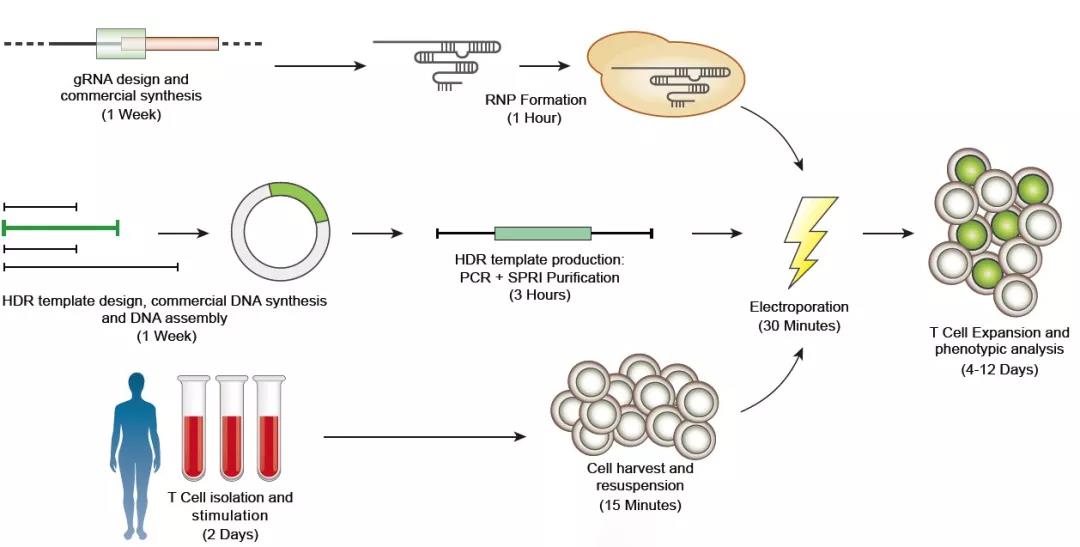
人类T细胞是生理免疫稳态的核心,它保护我们免受病原体带来的自身免疫炎症。T细胞也是目前大多数癌症免疫治疗的主要效应细胞。过去几十年的研究工作中,科学家致力于对T细胞进行基因修饰以用于治疗。由于人类T细胞对大多数传统的大片段DNA插入方法具有抵抗性,因此目前对T细胞的基因修饰方法多采用重组病毒作为载体,而这种方法导入的基因不靶向特定的基因组位点。此外,由于病毒载体的生产和测试周期漫长且花费巨大,因此依赖于病毒载体的基因修饰方法大大限制了其在研究和临床中的应用。基因组编辑通过同源定向修复(homology-directed repair,HDR)可以特异性和高效地将大的基因片段插入靶细胞,但迄今为止在人类T细胞中,这仍然需要病毒的介导。
在本研究中,研究人员开发了一种非病毒的CRISPR-Cas9基因组靶向系统,利用该系统可在原代人T细胞基因组的特定位点快速、高效地插入单个或多个大片段(>1kb)DNA序列,同时保持T细胞的活性和功能(图1)。研究人员利用这一系统成功地测试了其在临床应用中两种潜在的治疗手段。首先,研究人员纠正了来自原发性自身免疫性疾病的原代T细胞的致病性IL2RA突变,同时受突变影响的细胞信号得到恢复并增强(图2)。第二,研究人员用一种新的靶向肿瘤抗原的T细胞受体(T cellreceptor,TCR)取代内源性TCR,所产生的TCR-T细胞可特异性地识别肿瘤抗原、释放细胞因子并杀伤肿瘤细胞(图3)。
综上所述,该研究开发的不依赖病毒的基因修饰方法可实现对人原代免疫细胞进行快速、灵活的基因修饰操作,为该方法应用于临床治疗基因缺陷性疾病及肿瘤提供了临床前研究数据。
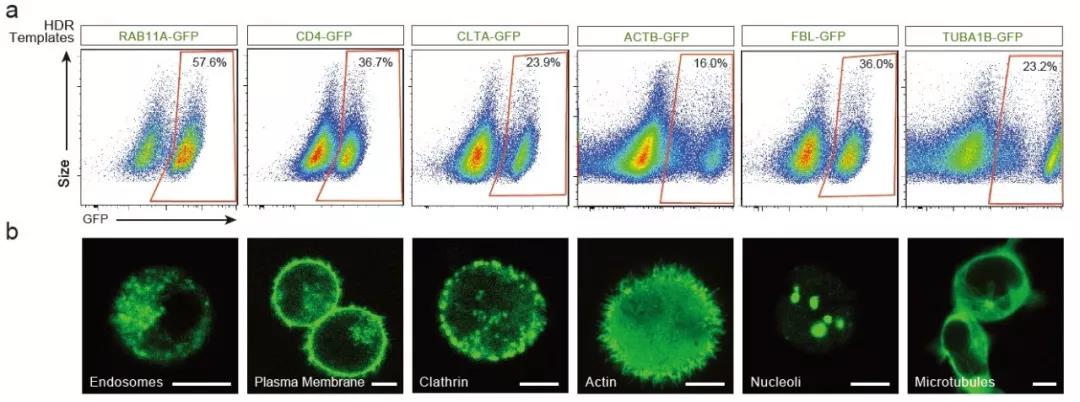
图1利用非病毒的CRISPR-Cas9基因组靶向系统将绿色荧光蛋白表达于T细胞的不同部位
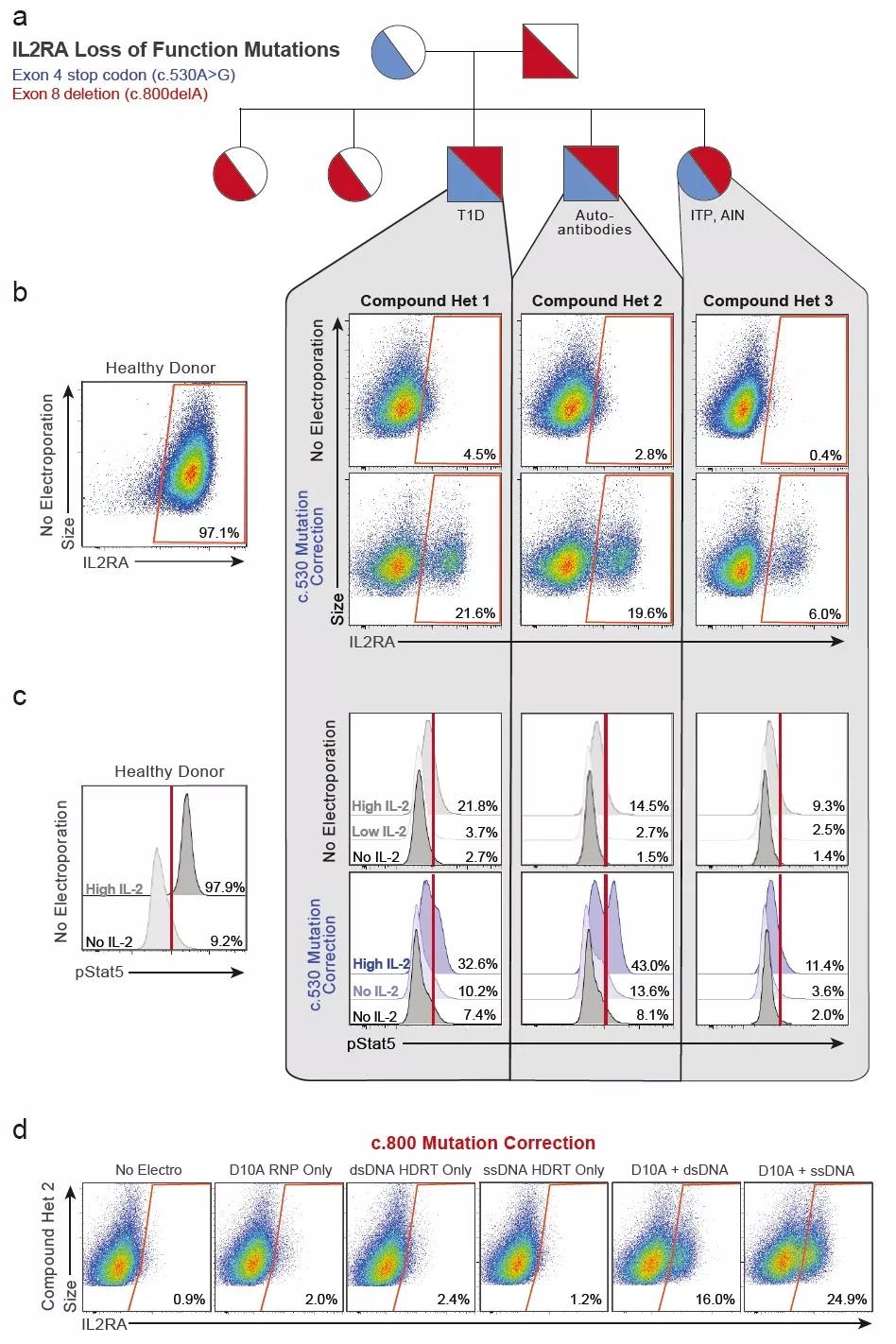
图2利用非病毒的CRISPR-Cas9基因组靶向系统修复人原代T细胞的IL2RA缺陷
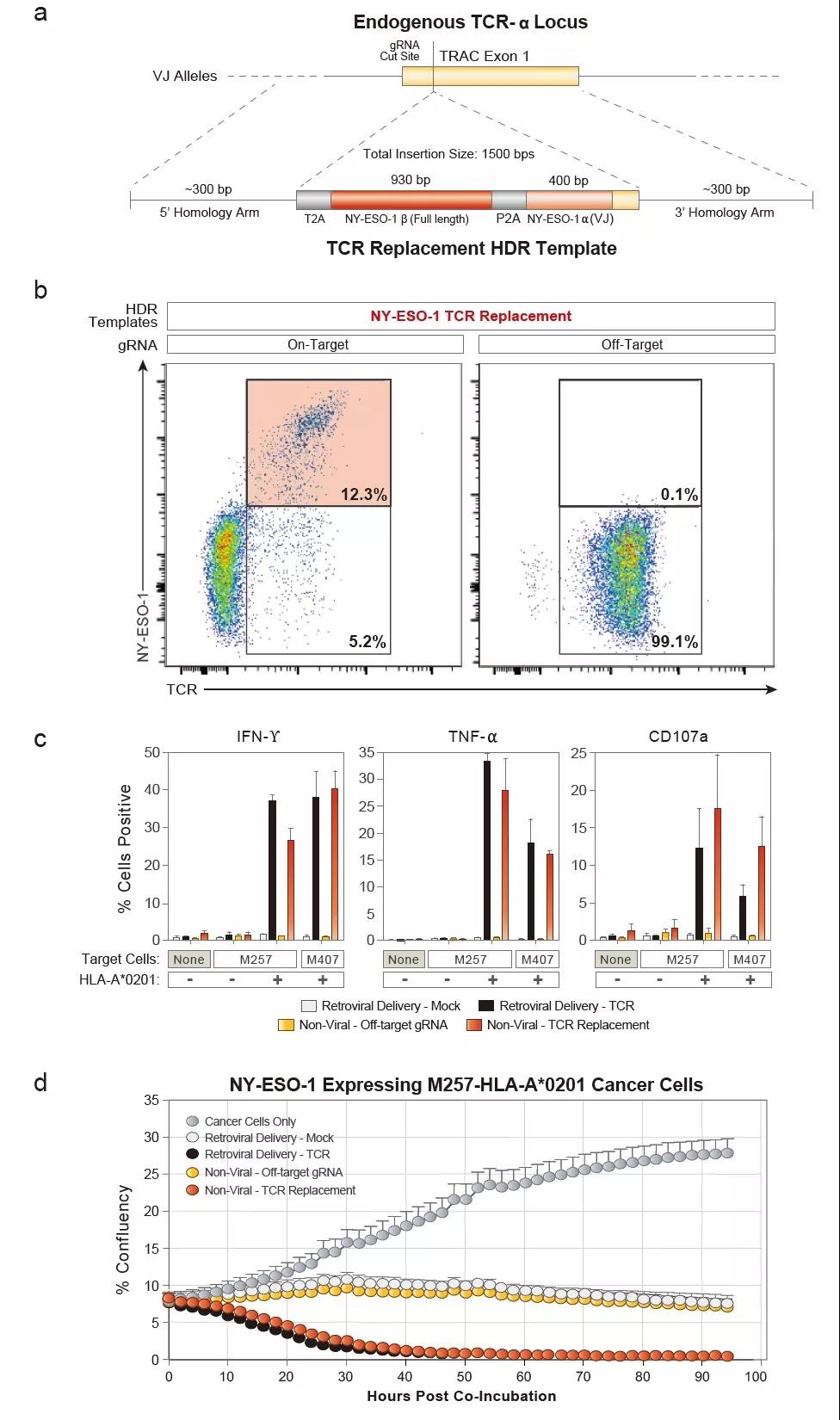
图3 利用非病毒的CRISPR-Cas9基因组靶向系统制备NY-ESO-1 TCR-T细胞可特异性杀伤NY-ESO-1阳性表达的肿瘤细胞
参考文献:Roth TL et al. Reprogramming human T cell function and specificity with non-viral genome targeting. NATURE 2018, DOI: 10.1038/s41586-018-0326-5
 关注公司微信公众号
关注公司微信公众号 地址:深圳市龙华新区宝能科技园